Galvanisk tæret aluminium er virkelig en af de ting jeg frygter mest når jeg tænker på restaurerings projekter.
Galvanisk tærring er altid et problem da aluminium på biler, både, fly…. you name it…. Altid er offer for galvanisk tærring.
Jeg har beslutte, at få afsluttet undervogns delene til Porschen, så der ingen vej udenom nok den MINDST betydningsfulde stump, der trods sin ydmyge funktion har kostet mig alt for mange timer allerede.
Et af de store problemer med de tidlige Porsche 924 turbo og Porsche 944 er, at for at spare uaffjedret vægt(lidt mere om det senere) har Porsche i sin tid prøvet, at anvende så mange aluminiums dele som muligt, hvilket i kombination med de mange jern elementer har skabt galvanisk tæring.

Dem der har fulgt mig på de sociale medier ved, at jeg den seneste tid har arbejdet med at få fremstillet en del af de komponenter der tilsammen skal være med til at gøre min Porsche 924 Turbo præcis så ukomfortabel, at jeg forventer en rygsøjle transplantation ugerne efter der er kommet plader på min Porsche.
Hvis du ikke følger bruuns garage på Facebook endnu så KLIK HER
Der er blevet drejet hårde bøsninger til det meste af baghjulsophænget i min Porsche 924 Turbo.

Jeg er nu nået til en blindgyde der har opslugt de fleste af mine vågne timer, de sidste par dage.
De bagerste ankerplader på min Porsche 924 turbo ligner noget der er bjerget fra Titanic pga. galvanisk tæring…. Og efter en hurtig, men grundig, rengøring er det muligt at besigtige skaderne.

Den ene side mangler helt og jeg har kun de sørgelige rester tilbage af den anden så der er ikke meget at arbejde videre udfra…
Den jeg har tilbage er stærkt medtaget af galvanisk tæring og ca 1/3 af ankerpladen er brækket af.
Heldigvis er højre og venstre side ens og de har derfor en symmetrisk form der muliggør, at genskabe den del der mangler på den tilbageværende ankerplade.
Desuden er jeg så heldig at jeg har et sæt ankerplader fra en tilsvarende bil der er et par år nyere. Disse dele er fremstillet i stål og er derfor ikke udsat for galvanisk tæring, så jeg kan gætte nu mig frem til hvordan resten af de originale aluminiums ankerplader har set ud og dermed rekonstruere et nyt sæt.

Hvorfor bruger du ikke dem i jern…?
- Fordi de er tungere
- Det giver et fedt projekt at kaste min tid og passion efter.
- Fordi det giver mig muligheden for at fortælle jer lidt om galvanisk tæring.
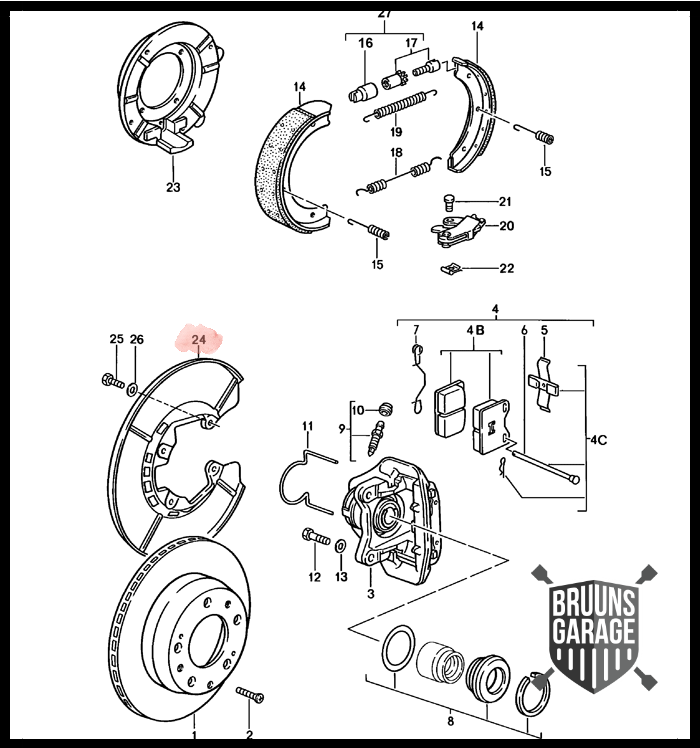
- Fordi jeg ELSKER tanken om at det er de bedste stumper jeg bruger i bilen. Ankerpladerne(nr. 24) kombineret med lejehuset(nr. 23) i aluminium vil spare mange gram uaffjedret vægt i forhold til de nyere jern dele.
På billedet ses vægt forskellen på stumperne der er lavet i jern og aluminium.
Det lyder måske ikke af meget men, hvis man tænker det som om at ant hvad der er monteret på bilen som ikke er affjedret påvirker fjederen med en G-kraft. Derfor er vægten afgørende for hvor stor den resulterende kraft der skal behandles af undervognen er.

1832g – 959g = 873
Det er 1746g sparet uaffjedret vægt…!
Også selv om der er knækket lidt af ankerpladen i aluminium så bliver det en betydelig forskel.
1746g —– Det er altså ret meget!
Hvorfor køber du ikke bare en ny…?

Jo det kan man ikke! Delene er NLA eller No Longer Available. Ofte når man restaurer gamle biler støder man ind i dette problem og oftest er løsningen at købe brugte dele fra ophuggede biler eller forliste projekter men…
Da ankerpladen på bagbremserne på min bil er fremstillet af aluminium og de er skruet fast med fire små forzinkede M5 bolte vil der uomgåeligt opstå galvanisk tæring.
Så ALLE Porsche 924 turbo med disse ankerplader har dette problem! På biledet, herunder ses, hvordan andre dele ved bremserne er påvirket af galvanisk tæring.
Disse stumper vil jeg dog ikke gøre noget ved da de alle er komplette og kun har kosmetiske skader.
Jeg kunne vælge at svejse de dele der var ramt af galvanisk tæring op og bagefter slibe dem fine.
Men af frygt for at ændre på metallets molekyle struktur ved opvarmningen, tænker jeg, at det er mest sikkert at lade dem være som de er.

Galvanisk tæring er en elektrokemisk proces der sker når to metaller med forskellige elektrokemisk aktivitet er i en elektrisk ledende kontakt med hinanden…
I kemiens verden taler man om at der sker en “Redox reaktion”
Redox er en sammentrækning af to ord Red-ox
- Reduktion er en optagelse af elektroner
- Oxidation er en afgivelse af elektroner
For at en redox reaktion kan opstå er der nogle ting der skal være på plads.
- Man skal have to forskellige metaller.
- De to metaller skal være elektrisk forbundet.
- Der skal være en elektrolyt til stede eks. vand.
Galvanisk tæring sker fordi, hvert stof har et forskellige elektroniske potentialer.
Præcis som i et batteri, hvor man mellem plus og minus kan måle en spænding(volt) kan man ved at sammensætte to forskellige metaller måle en elektrisk potentiale forskel mellem de to materialer.
Dette sker fordi der på grund af potentiale forskellen flyttes elektroner fra et materiale til et andet.
Om potentialet i et batteri ligger mellem 100.000V og 100.001,5V eller om det ligger mellem 0V og 1,5V vil begge situationer når man måler på batteriet have spændingen 1,5v

For at vise hvad der sker har jeg opstillet et simpelt eksperiment for at vise galvanisk tæring.
Jeg har placeret en aluminiumsplade og en messingplade (to forskellige metaller) i en lille beholder og har sat mit multimeter på, for at måle potentiale forskellen mellem de to materialer.

Som det ses på billedet er det ikke muligt at måle nogen spænding imellem de to materialer da der ikke er tilsat en elektrolyt endnu.
På næste billede ses, at jeg har tømt glasset med vand ned i karret og det er tydeligt at se at voltmetret viser 0,52 volt…

Forsøget viser at der sker en reaktion mellem de to metaller og at den ene afgiver elektroner og den anden optager elektroner.
Hvilket viser at der forekommer galvanisk tæring(REDOX) da der flyttes elektroner fra et materiale til det andet.
Præcis som i batteriet hvor der sker en vandring af elektroner fra minuspolen til plus polen.
Jeg prøvede at forurene vandet med salt men til min overraskelse gav det ikke nogen ændring i spændingen…
Så umiddelbart har saltindholdet ikke nogen effekt på elektrolysen, hvilket lægger mistanke om, at vinterkørsel har været grund til den galvaniske tæring til ro.
Dog har salt påvirkning på korrosion bare en anden type korrosion(fælles betegnelse for alle typer tæring), men det må vi snakke om en anden gang.
Hvert metal i det periodiske system har hvert et elektrokemisk potentiale og kan opstilles i en skala man kalder “spændingsrækken”.
Herunder er nogle eksempler på metaller og deres elektrokemiske potentiale. Man kan bare ikke regne med dem da man med kommercielle materialer altid vil have med legeringer at gøre, hvor metaller er blandet for at opnå forskellige egenskaber.
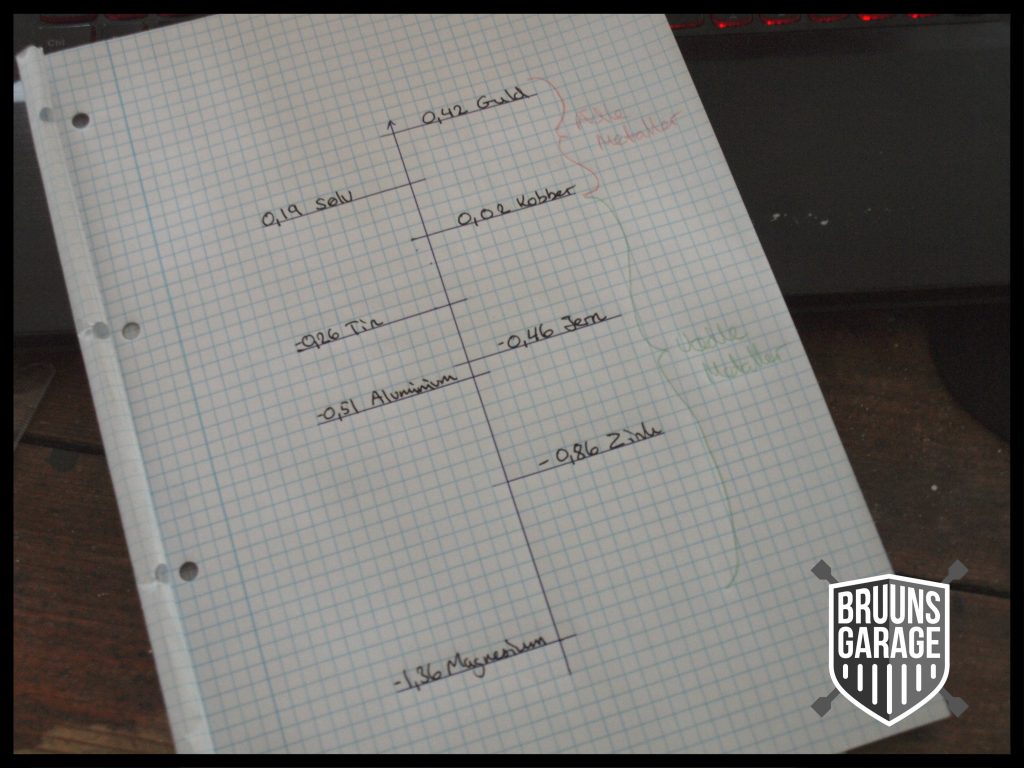
Man kan opstille en forsimplet spændingsrække, hvor man kan danne sig en ide om, hvorvidt springet mellem metallerne (potentialet) er stor eller lille:
Li Cs K Ba Ca Na Mg Al Mn Zn Cr Fe Co Ni Sn Pb H Cu Ag Hg Pt Au
Spændingsrækken er inddelt med de mindre ædle metaller til venstre og de mere ædle til højre med guld som det mest ædle.
Jo mindre ædelt et materiale er des mere vil det prøve at reagere derfor reagerer guld næsten ikke med andre grundstoffer.
Du har måske høt om kongevand som er en af de få opløsninger der kan reagere med guld.
De mindre ædle metaller vil altid prøve at reagere med de mere ædle(venstre) metaller ….
Jeg prøver igen…
De mindre ædle metaller vil altid prøve at reagere med de mere ædle(venstre) metaller ….
Det her kan være svært at huske men essensen i det hele er:
Metaller der har en lavere “rang” i spændings rækken vil gøre alt hvad der står i deres magt for at afgive elektroner i håbet om at blive mere “værdifulde”
Og metaller der har højere “rang” vil gøre hvad de kan for at optage elektroner fra de laverestående materialer.
Huskesætninger:
- Unge teenagepiger går i opløsning over synet af deres store idol…
- Bønderne må afgive deres overskud til de adelige.
Find selv på flere 🙂

En aluminiumsplade der har elektronisk forbindelse til zink og hvor der er en elektrolyt til stede vil derfor starte en redox reaktion pga. potentiale forskellen og elektrolytten.
Her har jeg opstillet sammensætningen som på Porschen hvor den galvaniske korrosion er foregået. på den ene side har jeg en jern plade og på den anden en aluminiumsplade.

Det ses at den elektrokemiske energi er 0,18V hvilket beviser at der flyttes elektroner fra det ene materiale til det andet og med tiden vil aluminiummet vise tegn på korrosion.
Men hvorfor har Porsche ikke tænkt på det?
Det har de også…!
Arealet forholdet imellem de to metaller spiller nemlig en stor rolle.
På billedet har jeg bare lagt proben(voltmetrets kontaktspidser) fra voltmetret ned i elektrolytten. Her burde det ses, at fordi overflade arealet på proben er langt mindre end aluminiumspladen er det elektro kemiske potentiale langt lavere end da det var hele jern pladen jeg målte på.
Resultatet er at voltmetret viser 0,2V hvilket er højere end før…
Hmmm probespidsen er belagt med krom så derfor er det ikke muligt at sammenligne resultaterne i eksperimenterne, men tag mit ord på det…
Der er en relation i mellem overfladeareal og galvanisk tæring!

Den elektrokemiske proces sker fordelt over hele emnets overflade, hvilket vil sige:
Da det mindre ædlemateriale, i dette tilfælde aluminium, har et stort overfladeareal sammenlignet med de fire små m5 bolte vil den galvaniske korrosion være fordelt over en stor overflade.
Dette vil sænke koncentrationen af processen og derfor vil den blive næsten ubetydelig.
Havde forholdet været omvendt. Altså havde alle delene været fremstillet i jern og derefter samlet af aluminiums bolte ville aluminiums boltene været korroderet væk i løbet af få måneder.
Så Porsches dygtigste ingeniører var altså ikke helt galt på den.
Dog har tiden og det miljø emnerne opholder sig i alligevel spist sin del af Porsches ellers udemærkede produkt.
Billedet viser at, hvis jeg måler imellem et par originale bolte og ankerpladen er der tydelig Redox reaktion. Dog er der i forsøgsopstillingen ikke taget højde for arealforholdet men det giver dog alligevel en indikation af hvad der sker når stumperne er monteret på bilen.

Men hvad så… Alt dette nørderi kommer der jo ikke nye ankerplader ud af, så der må arbejdes lidt på sagen.
Men nu håber jeg at det har givet lidt bedre forståelse af hvad der sker når metaller korrodere på grund af galvanisk tæring.
/Mads






